脳と腸はいったいどのようにして連絡を取り合っているのか……その経路について、前回(第5回)は「免疫系も大きな役割を担っている」ことを伝えました。今回はその続編になるので、まず、前回のポイントをまとめておきます。
・100兆個とも言われる細菌が常在している消化管には、人体最大の免疫組織と言われる「腸管関連リンパ組織(Gut-associated lymphoid tissue:GALT) 」が存在する。
・「免疫細胞」には、白血球に含まれる「好中球」「好酸球」「好塩基球」「単球」「リンパ球」などがあり、さらに、たとえば単球は「マクロファージ」や「樹状細胞」、リンパ球は「NK細胞」「キラーT細胞」「B細胞」「ヘルパーT細胞」などで構成される。それぞれに形状や働きが違う。
・免疫のしくみは、大きく2つの段階に分けられ、第1段階は「自然免疫」、第2段階は「獲得免疫」と呼ばれる。
・免疫細胞たちは「サイトカイン」という低分子のタンパク質によって情報を伝達している。サイトカインは800種類以上が知られ、感染症や炎症、外傷、がん、生殖、アレルギーなどに関与し、医療・健康分野の多くの情報を読み解くうえで重要な存在。
・ストレスがあると、免疫を抑制するホルモンである「コルチゾール」が分泌されて、免疫の機能が低下する。
今回は免疫系の働きの後編として、「腸管免疫」で注目されている組織の「パイエル板」や「免疫寛容」、肝臓と脳腸相関について述べます。
免疫の話題では、登場する細胞(キャラクター)が多く、ストーリーは勧善懲悪で完結しないので、「なんのことかわからない」という指摘もよく受けます。ただ新型コロナ感染症の流行の影響もあり、免疫については近ごろ、題材となった漫画が人気だということ、また学校の試験でも頻出だと聞きます。この機会に免疫の概要やキーワードだけでも触れていただき、脳腸と関係があるのか…と興味を持ってもらえれば幸いです。
■腸には「腸管免疫」で病原体を撃退する独特のしくみがある
消化管とは、口から食道、胃、十二指腸、小腸、大腸、肛門まで1本の管でつながっています。体内にありながら、実は外界にさらされているために「内なる外」とも呼ばれ、その形状はよく、ちくわにたとえられます。消化菅は、皮膚と同じように、体の外と内を分ける境界線の役割を担っているわけです。
ヒトの消化管の粘膜の表面積はどのぐらいあると思いますか。実は約400m2で、これはテニスコートの1.5面分、皮膚面積の約200倍もあるのです。
この広い消化管の内側は、多種の食べ物や細菌、ウイルスなどの「異物」と常に接しています。それだけに、病原体が侵入しやすい場所でもあるわけです。
そのため消化管には、病原体の侵入を防ぎながら、一方では有用な腸内細菌と共存し、食べ物の栄養素を吸収するという複雑な働きが求められます。
実は、それを可能にしているのが、「腸管免疫」なのです。腸管免疫とは文字通り、腸の免疫機能のことです。
たとえば、皮膚は複数の層で異物の侵入を防いでいますが、消化管は消化と吸収を効率的に行うために、上皮が一層だけです。しかし消化管には、粘液や消化液、免疫細胞、分泌型IgA(第5回参照)などの免疫機能で、腸内細菌と共存しながら病原体を撃退するしくみがあります。
その腸管免疫の特徴には、1つは「多種多様な免疫細胞が働いていること」、2つめは「腸内細菌や食べ物などの体に必要なものには免疫を抑える免疫寛容と呼ぶ働きがあること」が挙げられます。
■腸管免疫で注目! 活躍する「パイエル板」とは
まず、1つめの「多種多様な免疫細胞の働き」を見ていきましょう。多くの免疫細胞が関与する腸管免疫の主な拠点は、第5回で述べた「腸管関連リンパ組織(GALT)」です。これは腸管内に存在するリンパ組織全体を指し、細かく見ると、小腸の「パイエル板」、孤立リンパ小節、腸間膜のリンパ節、腸管のリンパ球などを含みます。
さて、その中のパイエル板は、腸管免疫を語るうえで注目されるキーワードです。
小腸の内側の粘膜は、「絨毛(じゅうもう)」と呼ぶ微小な突起で覆われています。この絨毛によって粘膜の表面積は増大し、そこから栄養分を吸収しています。
そして、パイエル板は粘膜のところどころ、絨毛の合間に点在していて、その数は100を超えると言われます。図1を見てください。1個ずつはリンパ球など複数の免疫細胞が集まる組織で、平たんな屋根のドームのような形をしています。
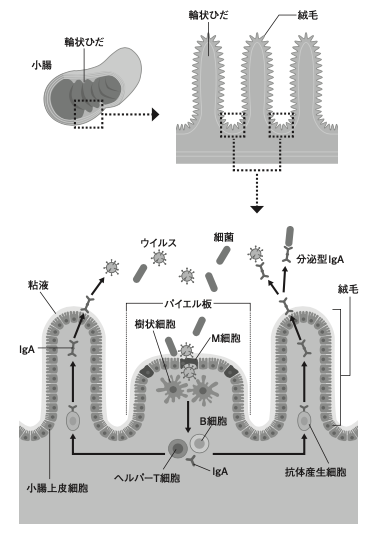
パイエル板はスイス人のパイエル医師によって1677年に発見されましたが、その役割は長くわからず、判明したのは1971年のことです。発見者の名前と、形状が「板」のように見えることから、パイエル板と名付けられました。
このパイエル板と小腸のリンパ組織を合わせると、人体最大のリンパ組織になり、腸には免疫細胞の過半数(一説には約70%)が集まっているという報告もあります。
パイエル板の表面には、免疫細胞の「M細胞」が存在し、細菌やウイルスなどの抗原がいると即座にそれらを内側に引きずり込みます。すると、そこに集結している免疫細胞のマクロファージや樹状細胞が細菌やウイルスをぱくっと食べて排除するのです(第5回で述べた「食作用」)。これが「自然免疫」の段階です。
さらに、免疫細胞たちの働きは次の段階へと続きます。
樹状細胞たちは、現時点の細菌やウイルスを排除するだけではなく、将来に侵入してくる同じ細菌やウイルスに備えるようにと、T細胞やB細胞に情報を送ります。
この情報を受けて、活性化したB細胞は「形質細胞」に変化して抗体である「IgA(免疫グロブリンA)」をつくり、腸管内や粘膜に分泌します。免疫ができた、ということです。
分泌されたIgAは、粘膜の表面で再び襲来する細菌やウイルスなどに結合し、排除したり、毒素を中和したりします。病原体をつかまえて退治する、ということです。
このように、一度侵入した細菌やウイルスの情報を記憶し、再び侵入されたときにはすぐさま対処できるように学習するしくみが「獲得免疫」です。文字通り、「免疫を獲得した!」という意味です。
こうして腸管免疫は複数の免疫細胞を駆使して細菌やウイルスなどの侵入を防ぎ、撃退し、さらに将来の侵入にも備えているわけです。
■食べ物など侵入者を受け入れる「免疫寛容」のしくみ
それでは、もうひとつの腸管免疫の特徴の「免疫寛容」とは、どのように調整されているのでしょうか。
食べ物や腸内細菌は消化管にとっては実は「侵入者」なのですが、免疫細胞たちがこれらを敵だとして撃退すると、ヒトは生きていけません。そうならないように、免疫系は体にとって必要なものは侵入者といえども撃退せずに、「受け入れる(寛容)」ように働きます。これが免疫寛容です。
もちろん、なんでもかんでも寛容すると、あらゆる感染症にかかりやすくなるので、「寛容するべきものだけを寛容する状態」が健康にとって望ましいわけです。
一方で、この免疫寛容が変調をきたすと、本来は無害な自分自身の細胞や組織を免疫細胞たちが敵と勘違いして攻撃してしまうことがあります。するとさまざまな臓器や皮膚、関節に不調が現れ、たとえば、花粉症、食物アレルギー、関節リウマチなどの病気を発症させます。なぜ免疫寛容が変調するのかを含め、これらの病気の原因はまだ明らかではありません。
■他の免疫細胞が過剰に働くのを抑える「Tレグ」に注目
免疫寛容、中でも腸管における免疫寛容を理解するにあたり、欠かせないある免疫細胞が存在します。それは「Tレグ(制御性T細胞)」です。
TレグはT細胞の一種で、他の免疫細胞が過剰に働くのを抑えます。前述の花粉症、食物アレルギー、関節リウマチなどで起こるアレルギーや炎症を抑えるわけです。
このTレグは、日本人の研究者である大阪大学・栄誉教授の坂口志文(しもん)博士が発見したことが世界的に知られています。Tレグを活用して、がんに対する免疫を強めたり、臓器移植に伴う拒絶反応を抑えたりすることへの応用が現在研究されており、ノーベル生理学・医学賞の候補としても注目されています。
少し専門的ですが、話題となることが多いので説明を加えると、Tレグの特徴を決める「Foxp3」という遺伝子の異常が、「IPEX症候群」という病気の原因になることが知られています。IPEXは免疫調節異常(Immune dysregulation)、多腺性内分泌障害(Polyendocrinopathy)、腸疾患(Enteropathy)を発症する、X連鎖(X-linked)劣性遺伝の頭文字です。
IPEX症候群は免疫が過剰に反応して、食べ物を含めてさまざまなものにアレルギーを起こす病気であり、治療しなければ生後1~2年以内に死に至るとされています。IPEX症候群は長らく原因不明の病気と言われてきましたが、近年、Tレグが正常に産生されないために起こることがわかってきました。
IPEX症候群の症状のひとつに腸疾患があると言いました。Tレグは全身に存在しますが、特に腸の中に多く存在し、食べ物へのアレルギーの抑制や、腸内の細菌との共存にも関わっています。
ほかの臓器では、すべてのヘルパーT細胞中、約10%がTレグであるのに対し、小腸では約20%、大腸では約30%をTレグが占めるとされ、そのことからも、腸管でのTレグの重要性が推測されています。
また、胸腺(胸の中央あたり、胸骨の裏にある組織)で成熟し、まだ細菌やウイルスなどの抗原と闘ったことのない未熟なT細胞を「ナイーブT細胞」と呼びます。これが胸腺を出て、リンパ節内で「抗原提示細胞」(第5回参照)と遭遇すると、その抗原と闘うT細胞に変化(分化)します。この変化で生じるT細胞のひとつにTレグがあるのです。
ナイーブT細胞をTレグに変化させるには、大腸では腸内細菌由来の抗原、小腸では食べ物由来の抗原の提示が関係していることが報告されています。
マクロファージや樹状細胞といった抗原提示細胞が、T細胞やB細胞に「これ、侵入者、もしくは変なやつだよ」と提示する抗原は、細菌やウイルス、そしてがん細胞などの正常でない細胞の情報です。第5回でも説明したように、免疫細胞は通常、ほかの免疫細胞から「あいつは敵だ」と抗原を提示されることで、侵入者や異物を選んで攻撃します。
しかし、Tレグの場合は、細菌と共存し、食べ物へのアレルギーを起こさないために、攻撃対象ではなく守るべき対象を知る必要があります。Tレグは共存する腸内細菌や食べ物の情報を抗原提示細胞から受け取り、免疫寛容を担うわけなので、ナイーブT細胞からの変容ぶりは人体の不思議として非常に興味深い、また理にかなっていると思われます。
■「肝臓―脳―腸」の相関
ナイーブT細胞がTレグに変化するには、最近の研究で、さらに脳腸相関も関連していることが報告されました。具体的には、腸の炎症の情報が血液に乗って肝臓に伝わり、肝臓内の迷走神経を通して脳へ、脳から再び迷走神経を介して腸管の粘膜層の神経に届きます。そうして神経周囲に存在する抗原提示細胞を活性化させて、Tレグへの変化を促すというものです(※1)。
実際、腸管に炎症が生じたマウスの迷走神経を切断すると、腸管内のTレグが著しく減り、結果として腸炎が悪化すると報告されています。なお、腸管の情報が、血液からどのように迷走神経に伝わるのかの詳細は報告されていません。
ただ、腸管に酸素を供給し、栄養を腸から吸収した血液のほとんどは肝臓に一度集められます。このため、栄養以外にも腸管の炎症や腸内細菌の情報が、何らかの形で肝臓の神経に伝わっていたとしても不思議ではありません。
このように、「腸の状態の情報が肝臓に伝わる」→「その情報が肝臓から脳に伝わる」→「その情報がまた腸に戻る」→「Tレグの量を調整して体の恒常性(第4回参照)を保つ」と考えられます。
なんだかややこしいなあ、と思われるかもしれませんが、かなり簡潔に言うと、腸の免疫寛容は、腸の中だけではなく、脳腸相関も介して調整され、全身の健康を保っているということです。
■腸内細菌は脳の免疫細胞にも関わる
このほか、脳と腸に関連する免疫の働きについて、次のような報告がされています。
かなり古い研究ではありますが、ネズミに対して卵白アルブミンを注射してアレルギー反応を引き起こす際に、音と光の刺激を同時に加えた場合、後日注射をせずに音と光刺激のみを与えた場合にも腸の肥満細胞がアレルギー反応を引き起こしたことが報告されています(※2)。
これはパブロフの古典的条件付け(第1回参照)と同じように、学習された脳の反応に対する体の反応が、脳と腸(および肺)の免疫細胞間でも起きていると考えることもできます。実際、この学習に関係していると思われる脳の局所を破壊すると、この反応は見られなくなったといいます。
この研究では、脳と腸管の肥満細胞をつなぐ情報伝達経路は報告されていませんが、近年の研究からは神経細胞などの関与が示唆されています。
また第5回で重要だと伝えた免疫細胞の情報伝達を行うサイトカインは、神経細胞にも作用するという研究報告があります。
たとえば、脳の神経細胞である「グリア細胞」の成長、増殖にはサイトカインのひとつである「インターロイキン1」が関係していることが報告されています。
また、グリア細胞の一種の「ミクログリア」は、脳内の免疫を司る細胞で、脳に侵入したウイルスなどの排除や、神経細胞の変性の修復をしています。このため、「脳のマクロファージ」と呼ばれることもあります。
無菌状態で生育されたマウスと、通常環境で生育されたマウスのそれぞれからミクログリアを取り出して比較すると、無菌マウスのミクログリアのほうは未成熟だといいます。興味深いことに、通常環境マウスの腸内細菌を無菌マウスの腸に移植すると、ミクログリアの成熟が進んだという結果も報告されています(※3)。
つまり、腸内細菌は、脳の免疫細胞であるミクログリアの成熟に関わっていると考えられ、これも広い意味での免疫を介した脳腸相関と言えるかもしれません。
ただし、Tレグにおける「肝-脳-腸相関」のように、免疫細胞が単独で脳と腸で情報を伝達しているというよりは、自律神経などを介したネットワークで連絡を取り合っているのではないか、というのが現在の見解です。
次回は脳腸相関の4つめの経路である「腸内細菌」について紹介します。
※1
Teratani T, Mikami Y, Nakamoto N, Suzuki T, Harada Y, Okabayashi K, et al. The liver-brain-gut neural arc maintains the T(reg) cell niche in the gut. Nature. 2020;585(7826):591-6.
※2
MacQueen G, Marshall J, Perdue M, Siegel S, Bienenstock J. Pavlovian conditioning of rat mucosal mast cells to secrete rat mast cell protease II. Science. 1989;243(4887):83-5.
※3
Erny D, Hrabě de Angelis AL, Jaitin D, Wieghofer P, Staszewski O, David E, et al. Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci. 2015;18(7):965-77.
阪河朝美・藤原 椋/ユンブル

「腸は第二の脳」という言葉が知られてきたが、最近の研究でそのメカニズムが医学的に説明できるようになってきた。そのエビデンスをもとに、ストレス関連消化管疾患の治療に、精神神経系疾患のうつ病や不安障害ケアの心理療法「認知行動療法」を取り入れる治療が始まっている。同治療法の研究者である消化器病専門医の著者によるこの研究成果と治療法、セルフケア法を一般に分かりやすく伝える。
プロフィール

菊池志乃
きくち・しの 名古屋市立大学大学院医学研究科共同研究教育センター助教。京都大学大学院医学研究科・健康増進・行動学分野・客員研究員。医学博士。消化器病専門医。消化器内視鏡専門医。京都大学大学院医学研究科博士課程医学専攻修了。高知大学・医学部医学科卒。岸和田徳洲会病院、天理よろづ相談所病院、高槻赤十字病院、京都大学医学部付属病院、京都大学大学院医学研究科特定助教を歴任。専門は過敏性腸症候群と認知行動療法。2022年、日本初の過敏性腸症候群に対する集団認知行動療法の大規模ランダム化比較試験を実施し、有効性を報告した。現在、名古屋市立大学にて過敏性腸症候群の臨床試験を実施中(https://suciri.localinfo.jp/)。


 菊池志乃
菊池志乃









 大塚久美子×塚原龍雲
大塚久美子×塚原龍雲

 苫野一徳×岩内章太郎×稲垣みどり
苫野一徳×岩内章太郎×稲垣みどり

